ファラデー定数(\(=9.65\times 10^4\) [C/mol])とは、電子の物理量あたりの電荷を表す定数です。イギリスの科学者、マイケル・ファラデーに因んでいます。
ここで、硫酸ナトリウム水溶液の電気分解において、発生する水素と酸素の体積と流れた電気量を測定し、測定データからファラデー定数を算出しています。
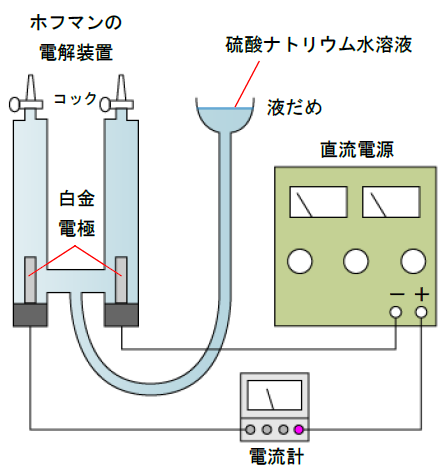
- 大気圧と室温を測定する
- ホフマンの電解装置のコックを両方開き、液だめから1.0[mol/L]硫酸ナトリウム水溶液を注ぎ、装置内を水溶液で満たしてコックを閉じる
- 電源装置のスイッチを入れて、120mAが流れるように調整する
- スイッチを入れて電気分解を開始する。18分後にスイッチを切り、気泡が上がりきった後、液だめの液面と電気装置内の液面の高さをそろえ、水素と酸素の体積をそれぞれ読みとる
- 測定結果を表にまとめる
| 室温 | 大気圧 | 水素の体積 | 酸素の体積 |
| 27℃ | 1005hPa | 18.2mL | 9.0mL |
水素の圧力は、1005-35.6=969.4hPa
⇒\(9.69\times 10^4\) [Pa]
水素の体積は、18.2mL ⇒ \(1.82\times 10^{-2}\) [L]
ここで、水素の物質量を \(n\) として、気体の状態方程式を適用すると
\(n=\dfrac{PV}{RT}\)
\(=\dfrac{9.69\times 10^4 \times 1.82\times 10^{-2}}{8.31\times 10^3\times 300}\)
\(=7.07\times 10^{-4}\) [mol]・・・①
18分の間に流れた電気量[C]は
\(120\times 10^{-3}\times 18\times 60\)
\(≒130\) [C]・・・②
水素の発生は
2H++2e–→H2
より流れた電子の物質量は、発生した水素の物質量の2倍である。・・・③
①, ②, ③より
ファラデー定数は
\(\dfrac{120}{2\times 7.07\times 10^{-4}}\)
\(=9.19\times 10^4\) [C/mol]